Система для анализа вариабельности сердечного ритма с учетом нелинейных компонент сигнала
| Захаревич В.Г. () - , Сахарова О.Н. () - | |
| Ключевое слово: |
|
| Ключевое слово: |
|
|
|
|
Организм человека – это сложная замкнутая многоуровневая система. Обеспечение заданного уровня функционирования целостного организма является конечным результатом деятельности сердечно-сосудистой системы. По структуре сердечного ритма, заложенного в последовательности RR-интервалов, можно судить об адаптационных механизмах, уровне функционирования вегетативной подсистемы организма, позволяющей выявить реакцию организма человека на стресс, а также провести экспресс-анализ текущего состояния. В настоящее время появилась возможность, используя вариабельность сердечного ритма (ВСР), проводить исследования системных критериев раннего и донозологического выявления напряжения и перегрузки механизмов адаптации и их нарушений при различных заболеваниях. Анализ показателей ВСР позволяет выявить закономерную связь между вегетативной нервной системой и смертностью от сердечно-сосудистых заболеваний, включая внезапную смерть. Экспериментально была установлена связь между предрасположенностью к летальным аритмиям и признакам повышенной симпатической или пониженной вагусной активности. Этот факт дал толчок к проведению исследований количественных показателей вегетативной активности. Современное развитие компьютерной техники дало возможность создать аппаратно-программный комплекс для анализа вариабельности сердечного ритма, что позволяет визуализировать и автоматизировать анализ RR-интервального ряда, реализовать алгоритмы его обработки и применить нелинейные методы оценки. Физиологические основы ВСР
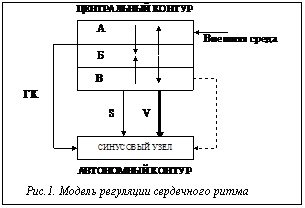
Живой организм можно рассматривать как многоуровневую самоуправляемую систему, состоящую из иерархически связанных двухуровневых элементов. Каждый такой элемент – это самостоятельная система, которая включает высший и низший (центральный и автономный) контуры, взаимодействующие на основе обмена информацией по каналам прямой и обратной связи. Уровень функционирования физиологических систем зависит от степени централизации управления: чем сильнее воздействие центрального контура на автономный, тем выше активность центральных механизмов управления, тем выше уровень функционирования системы в целом. Обычный (нормальный или средний) уровень функционирования физиологических систем обеспечивается при минимальной активации центральных механизмов управления. Автономная деятельность низших уровней освобождает высшие от необходимости постоянно участвовать в локальных регуляторных процессах. Высшие уровни участвуют в этих процессах только в том случае, когда низшие не справляются со своими функциями и необходима координация деятельности нескольких подсистем. Оптимальное сочетание принципов централизации и автономности управления в живом организме обеспечивает максимальные адаптационные возможности целостной системы при ее взаимодействии с окружающей средой. Сущность процессов регуляции заключается в непрерывном обмене информацией между контурами управления, которые имеют определенные временные характеристики. Необходимым условием формирования управляющих сигналов является наличие достаточного временного интервала для приема и переработки информации и числа элементов, контролируемых и управляемых данным регуляторным механизмом. Чем выше уровень регуляции (управления), чем больше различных уровней (элементов) он должен контролировать, тем больший интервал времени необходим для выработки управляющих сигналов. Рассмотрим модель регуляции сердечного ритма. На рисунке 1 представлена общепринятая иерархическая структура управления функциями, включающая последовательные уровни гуморальной, гормональной вегетативной и центральной (корковой) регуляции. Этим уровням соответствуют определенные анатомо-физиологические структуры: · подкорковые нервные центры, обеспечивающие вегетативный гомеостаз; · высшие вегетативные центры, осуществляющие уравновешивание гуморально-гормонально-вегетативных звеньев управления под контролем корковых механизмов; · центральная нервная система, координирующая все процессы управления в организме в соответствии с условиями окружающей среды. Общий подход к оценке ВСР заключается в том, что, во-первых, более высокие уровни управления рассматриваются как ингибиторы активности более низких уровней и, во-вторых, период колебаний ритма сердца связывается с уровнем управления: чем больше период, тем выше уровень управления. Таким образом, в ответ на разные нагрузочные воздействия могут наблюдаться различные изменения ритма сердца. При оптимальном регулировании управление происходит с минимальным участием высших уровней. В соответствии с представленной на рисунке 1 моделью регуляции сердечного ритма в качестве автономного контура выступает синусовый узел, на который оказывают влияние уровни центрального или управляющего контура. Эти уровни соответствуют процессам управления, обеспечивающим: · перестройку функциональной деятельности организма в связи с изменениями условий внешней среды (уровень А); · гомеостатическое регулирование взаимодействия различных физиологических систем внутри организма (уровень Б); · уравновешивание различных параметров внутри отдельных систем (уровень В). Уровень В центрального контура управления ритмом сердца является внутрисистемным. Он функционально и анатомически представляет единое целое с нервными структурами, участвующими в автономной регуляции. К этому уровню относятся вазомоторные центры, обеспечивающее локальное и общее приспособление сосудистой системы к изменению ударного и минутного объемов крови. Медленные волны Траубе-Геринга, обнаруживаемые обычно на кривых артериального давления и плетизмограммах, и аналогичные им волны в сердечном ритме отражают приспособительную деятельность уровня внутрисистемной регуляции, в котором осуществляется поиск оптимальных соотношений между притоком и оттоком крови и работой сердечного насоса. Уровень Б центрального контура управления ритмом сердца связан с межсистемным гомеостатическим механизмом. Его деятельность отражается в виде изменений сердечного ритма с периодами от нескольких минут до нескольких часов. Можно предполагать, что чем выше уровень регуляции, тем длиннее связанный с его активностью период колебаний сердечного ритма. Эта гипотеза исходит из принципа иерархической структуры системы управления, в которой каждое высшее звено должно обеспечивать перестройку низшего звена. Для этого необходимо, чтобы в высшем контуре мог быть осуществлен анализ хотя бы нескольких периодов колебаний, характеризующих состояние низшего контура. Таким образом, исследование колебательных составляющих сердечного ритма в диапазоне единиц, десятков и сотен минут приобретает большой научный и практический интерес, так как открывает путь познанию наиболее тонких механизмов регуляции физиологических функций путем исследования одного достаточно простого и доступного параметра – ритма сердца. Уровень А центрального контура управления ритмом сердца отражает взаимодействие организма с внешней средой. Его деятельность характеризуется прежде всего суточной периодикой сердечного ритма. Она проявляется также в переходных процессах, обусловленных взаимодействием различных факторов, таких как физическая или психическая нагрузка, изменения температуры окружающей среды или содержания в ней кислорода и углекислоты. Каждому уровню управления соответствует определенная анатомо-физиологическая структура. Превалированию или отсутствию влияния этой структуры можно поставить в соответствие некоторые состояния организма человека. Поэтому наиболее интересно исследовать закономерности этих явлений, а также переходные процессы из одного состояния в другое. Реализация нелинейного анализа RR-интервального ряда Как уже было сказано, ритм сердца модулируется и обеспечивается различными анатомическими структурами. Для исследования феномена регуляции сердечного ритма анатомическими структурами применяется анализ ВСР, или метод кардиоинтервалографии. Суть методики кардиоинтервалографии заключается в следующем. Регистрируется электрокардиограмма (ЭКГ) в трех основных отведениях (левая рука – правая рука, левая рука – левая нога, правая рука – левая нога). По полученной ЭКГ определяются интервалы между соседними R-зубцами, которые называются RR-интервалы, или кардиоинтервалы. Для реализации анализа вариабельности сердечного ритма необходимо от 100 (для линейного анализа) до 3000 (для нелинейного анализа) кардиоинтервалов. На основе полученных данных строится ритмограмма, где по оси абсцисс откладывается номер текущего значения RR-интервала, а по оси ординат – значение самого RR-интервала в секундах. Далее проводят статистический, гистографический, корреляционный и спектральный анализ ритмограмм. Для обработки кардиоинтервалов обычно применяется преобразование Фурье, которое фактически является реализацией спектрального анализа. Однако до сих пор не существует адекватных моделей функционирования физиологических систем организма, строящихся на основе спектрального анализа. Изначально метод Фурье-анализа был разработан для стационарных сигналов и идеально подходил для их описания. Представить нестационарный сигнал в виде суммы ряда синусоид точно практически невозможно, появляется погрешность, порядок которой в настоящее время не исследован. Появилась необходимость нахождения новых методов представления сигнала, позволяющих отойти от исследования линейных, стационарных процессов и перейти к анализу непосредственно нелинейных систем, со значительной долей случайных и квазислучайных факторов на ритм сердца и, как следствие, на общее состояние организма человека. В качестве принципиально нового подхода к анализу ВСР предлагается использовать методы нелинейной динамики. Нелинейный анализ кардиоинтервалограмм основан на восстановлении фазово-пространственного представления сигнала и дальнейшего рассмотрения некоторых количественных характеристик полученного портрета сигнала. Первым шагом в описании нелинейных процессов является попытка восстановить фазовое пространство сигнала или (в данном случае) ритмограмм. Наиболее простым методом фазово-пространственного восстановления является метод задержки Тэйкенса [7], который заключается в следующем. Координаты точки Х(k) в фазовом пространстве являются параметрами модели состояния восстановленного временного ряда в момент времени k. Поведение динамического состояния восстанавливается рядом из этих точек Х(k) в фазовом пространстве. Векторы X(k) в многомерном фазовом пространстве строятся по значениям временного ряда, который определяет координаты фазово-пространственного графика:
где Х(k) – одна точка кривой в фазовом пространстве в момент времени k; х(k+iτ) – это координаты в фазовом пространстве соответствующих значений временного ряда; τ – соответствующая временная задержка (целый малый дискретный период); ED – внутренняя размерность, которая является числом координат графика фазового пространства. Восстановленный сигнал представляется аттрактором в ED-пространстве. По восстановленному фазовому пространству необходимо определить аттрактор или притягивающее множество неравновесных состояний в фазовом пространстве, то есть некую совокупность точек, к которой притягиваются все близкие траектории движения [3]. Аттракторы бывают нескольких типов. Основными из них являются: · точка (устойчивый фокус), определяющая установившийся режим движения · предельный цикл, дающий периодически изменяющееся семейство состояний · тор · странный аттрактор, который не является многообразием, однако траектория движения системы, попав в область действия такого аттрактора, остается в ней сколь угодно долго [3]. Биологическим системам присущи именно странные аттракторы, и основной задачей восстановления фазового пространства является выявление такого аттрактора. Это позволяет поставить в соответствие формам аттракторов различные дисфункции регуляторных механизмов организма человека. Следующим этапом анализа нелинейных эффектов является нахождение характеристики полученного аттрактора, называемой корреляционной размерностью, метод оценки которой был предложен Grassberger и Procaccia [5]. Предположим, что X – регистрируемая ритмограмма; τ – задержка или лаг; r – радиус вокруг каждой точки отсчета, тогда получим значение корреляционного интеграла
где Хi ,Хj – точки кривой в фазовом пространстве; N – число точек данных в фазовом пространстве; Hev(х) – функция Хевисайда, которая Hev(x)=0 для х<0 и Hev(x)=1 для х>0, таким образом, она исключает значения вне радиуса r. Из выражения (2) получим выражение для построения корреляционной размерности
Программное обеспечение анализа ВСР На основе представленного нелинейного анализа, а также традиционно используемого линейного анализа совместно с НМФ «НейроТех» был разработан аппаратно-программный комплекс для реализации методики кардиоинтервалографии. Программное обеспечение реализует функции ввода сигнала в ПК, отображение его в масштабах времени и амплитуды, автоматизированной идентификации R-зубцов и определения RR-интервалов, запись в базу данных, а также визуализацию результатов работы линейных и нелинейных алгоритмов обработки RR-интервального ряда. Также имеется возможность формирования отчетной формы с результатами анализа. При использовании этого комплекса была набрана база данных пациентов, состоящая из 1500 записей. На данном этапе проводятся исследования и разработки алгоритмов классификации аттракторов с учетом оценки влияния их на уровни регуляции сердечного ритма с целью определения соответствия между типами получаемых аттракторов и уровнями регуляции сердечного ритма. Исследуются возможности использования для этих целей теории эволюционного моделирования и генетического поиска. Список литературы 1. Баевский Р.М., Кириллов О.И., Клецкин С.З. Математический анализ сердечного ритма при стрессе. 3-е изд. - М., 1984. - 315 с. 2. Лебедь А.Н. Кардиоинтервалограф. 1-е изд. - М. - 1978. - 158 с. 3. Колесников А.А. Синергетическая теория управления. 1-е изд.- Таганрог-М.: ТРТУ- Энергоатомиздат.- 1994.- 343 с. 4. Malliani A, Pagani M, Lombard F, Cerutti S. Cardiovascular Neural regulation explored in the frequency domain.Circulation: 1991; 84: 1482-92. 5. Kienzle MG, Ferguson DW, Birkett CL, Myers GA, Berg WJ, Mariano DJ.Clinical Hemodynamic and sympathetic neural correlates of heart rate variability in congestive heart failure. Am J Cardiol 1992; 69: 482-5. 6. Schmidt G, Monfill GE.Nonlinear methods for heart rate variability assessment.In: Malik M, Camm AJ, eds.Heart rate variability.Armonk: Futura, 1995: 87-98. 7. Otakar Foit and Jiri Holcik Applying nonliner dynamics to ECG signal processing.: Engineering in medicine and biology, number 2, 1998, 96. |
http://swsys.ru/index.php?id=712&lang=.&page=article |
|
Perhaps, you might be interested in the following articles of similar topics:
- Формирование программ развития больших систем административно-организационного управления
- Разработка загрузчика программного обеспечения встроенной системы управления
- Оптимизация обработки информационных запросов в СУБД
- Метод интегрированного описания топологических отношений в геоинформационных системах
- Зарубежные базы данных по программным средствам вычислительной техники

 Рассмотрим процесс формирования ритмограммы с точки зрения физиологии. Под ритмограммой понимается временной ряд значений RR-интервалов, получаемых путем идентификации R-зубцов на электрокардиограмме и определения временного интервала между ними.
Рассмотрим процесс формирования ритмограммы с точки зрения физиологии. Под ритмограммой понимается временной ряд значений RR-интервалов, получаемых путем идентификации R-зубцов на электрокардиограмме и определения временного интервала между ними. (1)
(1) (2)
(2) (3)
(3)