Методы метаанализа можно отнести к двум моделям – модели с фиксированными эффектами (fixed effect model) и модели со случайными эффектами (random effect model) [1]. Модель фиксированных эффектов предполагает, что исследования, для которых выполняется метаанализ, проводились при одних и тех же условиях над одним и тем же объектом. Модель случайных эффектов, напротив, учитывает влияние внешних факторов на результаты исследований с помощью анализа дисперсии между ними.
В медицине вопросы подбора лечения непосредственно связаны с клиническими проявлениями болезни, которые определяют подбор лечебных препаратов. К примеру, больных с печеночной недостаточностью можно разделить на группы, определяющиеся проявлением релевантных признаков. На этой основе можно подбирать оптимальную терапию. Но для этого нужны аналогичные по проявлениям группы больных с завершенными результатами лечения. Эти группы можно формировать по литературным данным с помощью метаанализа. Такой подход может повысить эффек- тивность лечения, так как будут учитываться исходные внешние факторы и развивающиеся в процессе болезни патологические изменения, а в идеальном варианте и «глубинные» молекулярно-генетические и биохимические проявления. Это будет соответствовать персонализированной таргетной (направленной) терапии. Одним из условий такого подхода является построение теорети- ко-множественной модели заболевания, варианты которой можно использовать в процессе метаанализа.
Основные методы метаанализа
Метаанализ – синтез данных из разных, но подобных, то есть сопоставимых, исследований, итог которого – количественная оценка обобщенных результатов с использованием статистических методов. В биомедицинских науках метаанализ – это систематическая, упорядоченная и структурированная оценка изучаемой проблемы, проводимая с использованием информации из ряда независимых исследований. Цель метаанализа – интегрировать полученные данные, сгруппировать их и опреде- лить общую тенденцию [2].
Одним из первых этапов метаанализа является оценка гетерогенности (статистической неоднородности) результатов эффекта вмешательства в разных исследованиях [3]. Источниками гетерогенности результатов разных исследований принято считать дисперсию внутри исследований (обусловленную случайными отклонениями результатов разных исследований от единого истинного фик- сированного значения эффекта), а также дисперсию между исследованиями (обусловленную различиями между изучаемыми выборками по характеристикам больных, течению заболеваний, лечебных вмешательств, приводящими к несколько отличающимся значениям эффекта – случайным эффектам).
Для оценки гетерогенности исследований обычно используют критерий χ2 (критерий согласия Пирсона) с нулевой гипотезой о равном эффекте во всех исследованиях и с уровнем значимости 0,1 для повышения статистической мощности (чувствительности) теста [4].
Таким образом, если различия между исследованиями обусловлены исключительно случайными факторами и сами исследования варьируются вокруг общего среднего терапевтического эффекта (то есть исследования гомогенны, дисперсия между исследованиями близка к нулю), такую модель можно назвать моделью с фиксированными эффектами, поскольку значение терапевтического эффекта одинаково для всех исследований. В этой модели пользуются методом Кохрана–Ментела–Ханзела. Таким образом, модели с фиксированными эффектами наиболее подходят для ситуаций, когда аналитик имеет доступ к максимально широкому спектру исследований по конкретной проблеме и эти исследования достаточно гомогенны в рамках постановки клинического вопроса, использованных методов исследования и методов представления полученных результатов.
Если же каждое отдельное исследование опирается на данные специфичных групп пациентов и как итог – различный терапевтический эффект (то есть исследования гетерогенны), можно говорить о модели со случайными эффектами.
Модель фиксированных эффектов. Метод Кохрана–Мантеля–Хензеля
Метод Кохрана–Мантеля–Хензеля (CMH-метод) – статистический метод, широко применяемый для исследований с контрольной группой, если исследования гомогенны и сравнимы [5]. Для каждого исследования составляется таблица сопряженности формата 2×2, в которой представлено число успешных и неуспешных испытаний для двух групп – группы, получающей лечение (препарат), и контрольной группы, получающей плацебо. Таких исследований может быть сколь угодно много. Пусть K – общее количество исследований. Тогда ячейки каждой k-й таблицы сопряженности Mk заполняются так, как показано в таблице 1.
Таблица 1
Таблица сопряженности
Table 1
Contingency table
|
Экспериментальная группа
|
Успешное лечение
|
Неуспешное лечение
|
Всего
|
|
Препарат
|
nk11
|
nk12
|
nk1j
|
|
Контроль
|
nk21
|
nk22
|
nk2j
|
|
Всего
|
nki1
|
nki2
|
nkij
|
В таблице nkij – количество результатов исследований, соответствующих ячейке Mk[i, j].
Формула расчета значения величины CMH имеет вид
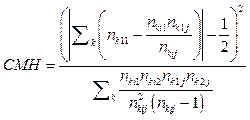 .
.
За нулевую гипотезу обычно принимают случай, когда лечение не оказывает воздействия, то есть неэффективно. Тогда значение СМН будет близко к единице. Чем больше значение СМН отличается от единицы, тем эффективнее лечение.
Модель случайных эффектов
Модель случайных эффектов предполагает, что эффективность изучаемого вмешательства в разных исследованиях может быть разной. Данная модель учитывает дисперсию не только внутри одного исследования, но и между разными исследованиями. В этом случае суммируются дисперсии внутри исследований и дисперсия между исследованиями.
Метаанализ с использованием байесовского метода позволяет рассчитать априорные веро- ятности эффективности вмешательства с учетом косвенных данных. Такой подход особенно эффективен при малом числе анализируемых исследований. Он обеспечивает более точную оценку эффективности вмешательства в модели случайных эффектов за счет объяснения дисперсии между разными исследованиями [6].
Метод доверия профиля – один из способов применения байесовского метода для интерпретации, корректировки и объединения доказательств, основан он на распределении вероятностей для параметра [7]. Параметрами могут быть здоровье пациента, различные переменные, используемые в моделях чувствительности при диагностике или в моделях вероятности риска. Например, для исследований с низким уровнем контроля может быть добавлена вероятность того, что часть пациентов на самом деле не получали лечение (препарат), так как забывали принимать таблетки.
При оценке доказательств проблемой является наличие необъективности в исследовании, в то время как различием между методом доверия профиля и прочими методами метаанализа является явное обозначение предвзятости и ее включение в распределение для интересующего параметра. По ряду причин отдельный эксперимент может определить связанный, но несколько иной параметр, или параметр эффективности. Если параметр эффективности не идентичен искомому параметру, доказательство является предвзятым.
Ряд внешних и внутренних факторов могут свидетельствовать о необъективности проведенного эксперимента. Внутренние факторы:
- неточность в измерении результатов исследований;
- фактические или формальные ошибки в получении лекарственной терапии;
- пересечение групп: некоторые пациенты, которым назначено лечение (препарат), могли в действительности его по каким-либо причинам не получать («разбавление»), или некоторые пациенты в контрольной группе могли получить реальное лечение (препарат) вместо плацебо («загрязнение»);
- различия пациентов в обеих группах («предвзятый выбор пациентов»);
- «потеря» пациентов для последующего наблюдения;
- неопределенность в отношении фактического числа случаев или результатов.
Внешние факторы:
- различия между группой людей, участвующих в эксперименте, и целевой группой;
- различия между технологией, используемой в эксперименте, и технологией, представляющей интерес (например, различие типа применяемого оборудования, дозы препарата, опыта врачей в подборе лечения – препаратов, дозировок);
- различия в результатах последующих экспериментов;
- различия в мерах воздействия в ходе эксперимента.
Кумулятивный метаанализ – частный случай байесовского метаанализа – пошаговая процедура включения результатов исследований в метаанализ по одному в соответствии с каким-либо принципом (например, по мере изменения методологии качества исследования) [8]. Кумулятивный метаанализ позволяет построить кумулятивную кривую накопления оценок при появлении новых данных [9].
Кумулятивный метаанализ заключается в последовательном добавлении отдельных исследо- ваний в анализируемую группу исследований (выборку). На первом шаге анализируется одно исследование, затем анализируются первое и второе исследования, затем первое, второе и третье иссле- дования и т.д. до тех пор, пока не будут объединены все исследования.
Итоговый результат (характеристики, полученные для объединенного исследования) во всех видах метаанализа должен совпадать. На основании промежуточных результатов анализа делаются выводы о достоверности проявления эффекта в отдельных исследованиях. Отсутствие существенных отклонений частного результата (без учета каждого из отдельных исследований) от конечного (по объединенному исследованию) является подтверждением достоверности и надежности полученных результатов [10].
Регрессионный метаанализ (варианты – логистическая регрессия, регрессия взвешенных наименьших квадратов, модель Кокса и др.) используется при существенной гетерогенности результатов исследований и позволяет учесть одновременное влияние нескольких факторов (например, размера выборки, дозы препарата, способа его введения, характеристик больных и др.) на результаты испытаний вмешательства. Независимая переменная носит название «предиктор» или «регрессор». Зависимая переменная – переменная отклика.
Цели регрессионного анализа:
- определение степени детерминированности вариации (изменчивости) зависимой переменной переменными-предикторами;
- определение вклада отдельных независимых переменных в вариацию зависимой переменной;
- проверка гипотезы о значимости регрессии;
- построение модели, позволяющей по значениям независимых показателей получать оценки значений зависимой переменной;
- оценка степени адекватности полученной модели.
Существует несколько видов регрессионного анализа. Простая линейная регрессия применяется для оценки связи между одной количественной непрерывной предикторной переменной и одной количественной переменной отклика (зависимой переменной): Y = b0 + b1X.
Множественная линейная регрессия применяется для оценки связи между двумя и более непрерывными или категориальными предикторами и одной непрерывной зависимой переменной отклика: Y = b0 + b1X1 + b2X2 + … + bnXn.
Логистическая регрессия используется для оценки связи между одной (двумя и более) не- прерывной или категориальной предикторной переменной и одной категориальной (бинарной) зависимой переменной отклика. Бинарная переменная – переменная, принимающая всего два возможных значения: 0 – событие не произошло и 1 – событие произошло. Иными словами, логистическая регрессия позволяет предсказать вероятность наступления события по значениям одного или более качественных или количественных признаков. Бинарная зависимая переменная преобразуется в непрерывную переменную, принимающую значения на интервале [0; 1].
Нелинейная регрессия, один из наиболее сложных видов регрессионного анализа, применяется для оценки переменных, связанных нелинейной зависимостью, которая, как правило, не может быть трансформирована в линейную.
Полиномиальная регрессия используется для выявления любой криволинейной зависимости между переменными, представленными в виде полиномов (многочленов) или матриц 2-й, 3-й и т.д. степеней.
Регрессия пропорциональных рисков Кокса применяется для выявления связи между двумя и более количественными или качественными предикторами и одной количественной зависимой переменной – временем до наступления какого-либо события.
Метарегрессия – разновидность множественного регрессионного анализа, применяющаяся в сочетании с метаанализом. Основное отличие состоит в том, что в качестве данных используются результаты отдельных исследований, включенных в метаанализ (но не результаты обследования отдельных пациентов) [11].
Инструменты метаанализа
Современные программные инструменты, предназначенные для метаанализа, как правило, поддерживают все наиболее распространенные методы, в связи с чем при выборе того или иного ПО на первый план выходят удобство использования, способы ввода и вывода данных, цена, а также возможность интеграции метааналитического инструмента в собственные программные решения.
· Удобство использования – понятие субъективное. Как правило, конечный пользователь стремится работать с тем инструментом, с которым работал ранее. Однако большинство инструментов поддерживают только ОС семейства Windows, для других распространенных ОС (Unix-системы, Mac OS) найти поддерживаемый программный продукт весьма сложно.
· Способы ввода и вывода данных – ввод данных, как правило, реализован с помощью импорта таблиц различных форматов. Логично, что, чем больше форматов ввода данных поддерживается, тем инструмент удобнее. Вывод данных реализуется в виде таблиц, но результаты метаанализа представляют также в наглядном, графическом виде, обычно с помощью графиков типа «форест-плот».
· Возможность интеграции – наверное, наиболее значимый фактор в современном мире. По- добная возможность максимально расширяет границы использования метааналитического инструмента. Однако для интеграции необходим исходный код.
В исследовании были выбраны наиболее попу- лярные для проведения метаанализа утилиты, как требующие покупки (Comprehensive Meta-Analysis и MedCalc), так и свободно распространяемые (RevMan и OpenMeta Analyst). Необходимо отметить, что платные программы обладают большими возможностями ввода и вывода информации, поддерживают большее число форматов файлов, включая специфические форматы конкурентов. Рассмотренные платные продукты ориентированы на пользователей ОС семейства Windows, в то время как свободно распространяемое ПО совместимо с большим количеством операционных систем.
В практической работе нужен программный продукт для поддержки всего цикла подбора лечебных препаратов при разных формах печеночной недостаточности, позволяющий выбрать и применить конкретный метаанализ. На этапе, предшествующем метаанализу, должна быть построена модель патологического состояния, в данном случае печеночной недостаточности, позволяющая работать с различными клиническими вариантами болезни на этапах ее развития.
Клинические особенности печеночной недостаточности
Печеночная недостаточность является патологическим состоянием, которое может быть острым либо хроническим и развивается вследствие различных причин [12]. В основе патогенеза печеночной недостаточности лежит уменьшение массы функционирующих клеток, что ведет к неспособности печени полноценно обеспечивать синтети- ческие и детоксикационные функции [13]. В результате снижения данных функций у больного повышается уровень билирубина, выявляется коагулопатия, которая клинически проявляется увеличением международного нормализованного отношения (МНО) или протромбинового времени, и могут развиваться такие тяжелые осложнения, как энцефалопатия и асцит [14, 15].
В разных регионах мира (Азиатском, Европейском и Американском) существуют свои характеристики термина «печеночная недостаточность». В разных регионах отдают предпочтение различным особенностям данной нозологии: в Европе и Америке внимание акцентируют на высокой смертности среди больных из-за полиорганной недостаточности, в то время как в странах Азии отмечают признаки, общие для всех типов печеночной недостаточности. При этом различие заключается в сроках развития заболевания. Сравнение классификаций представлено в таблице 2.
Как видно из таблицы 2, многие признаки, характерные для печеночной недостаточности в целом, в различных классификациях совпадают.
Таблица 2
Параметры печеночной недостаточности по регионам мира
Table 2
Parameters of ACLF liver failure in world regions
|
Критерий
|
Россия
|
Азия
|
Европа, Америка
|
|
Желтуха
|
+
|
+
|
+
|
|
Коагулопатия
|
+
|
+
|
+
|
|
Осложнения
|
Энцефалопатия
|
+
|
+
|
+
|
|
Почечная недостаточность
|
+
|
|
+
|
|
Дыхательная недостаточность
|
|
|
+
|
|
Сосудистая недостаточность
|
|
|
+
|
|
Портальная гипертензия (асцит)
|
+
|
+
|
+
|
Помимо классификации печеночной недостаточности по типам, существует классификация по стадиям.
В отечественной литературе встречаются классификации, отличные от западных, в них акцентируется внимание на степени проявления печеночной энцефалопатии (нейропсихических расстройств), которая определяется шкалой комы Глазго, включающей пять стадий [14].
Терапевтическое лечение печеночной недостаточности направлено на этиопатогенетические факторы основного заболевания, поддержание функций печени и купирование осложнений, таких как энцефалопатия и коагулопатия [14]. Однако в случаях, когда для оказания полноценной помощи пациенту недостаточно терапевтического лечения, необходимо прибегнуть к экстракорпоральным методикам, таким как гемодиализ, плазмаферез, плазмосорбция и различные их вариации [16].
Различные классификации печеночной недостаточности определяют выбор тактики лечения. В то же время лечение во многом обусловлено наличием в конкретных случаях определенных синдромов (симптомокомплексов). Именно это позволяет выдвинуть единую модель построения печеночной недостаточности для решения вопросов диагностики и выбора тактики лечения.
Принципы и критерии модели печеночной недостаточности
Современные информационные технологии позволяют строить модели, помогающие в выборе методов лечения на основе интеллектуального анализа клинических данных. В качестве подхода, включающего различные формы заболевания, авторами была выбрана синдромальная модель пациента, которая, в соответствии с Национальным стандартом Российской Федерации. Клинические рекомендации (протоколы лечения) определяется совокупностью клинических, лабораторных, инструментальных диагностических признаков, позволяющих идентифицировать данный синдром и отнести его к группе состояний с различной этиологией, но с общим патогенезом (механизмом развития заболевания). В основе синдромальной модели пациента лежат конкретный синдром (симптомокомплекс), стадия и фаза заболевания, возможные осложнения.
В данной постановке для построения модели пациента с печеночной недостаточностью был выбран теоретико-множественный подход [17]. В основу модели положены множества – группы кри- териев, состоящие из подмножеств – синдромов, клинических симптомов и других параметров пациентов. Нужно отметить, что математической моделью для представления многопризнаковых объектов является мультимножество, или множество с повторяющимися элементами [18]. Но при этом разнообразие или нечеткость отдельных проявлений болезни обусловливает последовательность хотя и сходных, но отличающихся множеств. Бертран Рассел [19] обращал внимание на то, что «множества явлений различаются время от времени». Это касается и заболеваний, что приводит к динамике изменений у пациентов. Фактически выстраивается ряд похожих описаний, особенности проявлений патологии у которых соответствуют понятию нечеткого образного ряда. Такой порядок отображения позволяет выйти на искомый понятийный образ даже при относительно отдаленном представлении клинической картины, чему соответствует понятие нечеткости [20]. Встречающиеся у пациентов варианты болезни и отдельных синдромов нередко определяют последующий подбор эффективных или неэффективных методов лечения и обязательно должны учитываться врачами.
Для разработки модели пациента с печеночной недостаточностью, по которой в дальнейшем планируется осуществлять метаанализ, были проанализированы различные исследования российских и зарубежных авторов. В процессе анализа данных работ уточнены основные симптомы, которые характеризуют больных с различными типами печеночной недостаточности. Выделенные симптомы были подразделены на несколько групп. Первую группу составили специфические синдромы и симптомы, подтверждающие наличие печеночной недостаточности у пациента. Целесообразным представляется называть их критериями включения. Также были выделены критерии исключения, представляющие вторую группу. Выявленные в исследовании критерии исключения помечаются как не отвечающие требованиям и не включаются в метаанализ. К третьей группе отнесены неспецифические проявления данной патологии. Из литературы видно, что некоторые авторы специально отбирали для исследования пациентов с неспецифическими проявлениями, а другие специально отсеивали таких больных. Данная группа признаков обозначена авторами как неспецифические критерии.
 На основе литературных данных, характерных для разных стран мира и России, сформирована таблица признаков (критериев) (табл. 3), используемая в построении модели.
На основе литературных данных, характерных для разных стран мира и России, сформирована таблица признаков (критериев) (табл. 3), используемая в построении модели.
Критерии, подтверждающие наличие у пациента печеночной недостаточности, должны использоваться в модели комплексно. Другими словами, при наличии у пациента повышенного уровня билирубина, увеличения МНО или уменьшения протромбиновой активности, асцита и/или энцефалопатии можно утверждать, что у больного именно данное заболевание.
В исследование не включались пациенты с признаками из группы критериев исключения, что позволяло отсекать случаи, которые было решено исключать еще на этапе постановки задачи.
Существенное значение имели неспецифические критерии, которые могли служить отягощающим фактором и затруднять подбор медикаментозной терапии. Однако важность их рассмотрения определяется именно необходимостью коррекции традиционной терапии печеночной недостаточности. В связи с этим одной из важных задач исследования был подбор пациентов не только с характерными симптомами, но и нуждающихся в сочетанной терапии, учитывающей особенности их других заболеваний, то есть случаев, в которых проводилось лечение пациентов, наиболее близких по своим клинико-лабораторным параметрам.
Теоретико-множественная модель пациента
Печеночная недостаточность как полисистемное заболевание характеризуется динамикой изменений, определяемых различными факторами. Для описания структуры патологии у пациента часто используются так называемые теоретико-множественные модели, когда в описании объекта моделирования как системы используются множества и заданные на этих множествах отношения.
Теоретико-множественная модель пациента с печеночной недостаточностью строится на основе разнотипных данных, характеризующих различ- ные варианты заболевания и этапы его течения, в том числе встречающиеся в разных регионах мира. Она опирается на клинико-лабораторные и инструментальные параметры, включающие признаки, их характеристики и значения.
Строго говоря, все способы задания формального описания не более чем отношения. Однако, когда говорят о теоретико-множественной модели, имеют в виду предельно общий вид модели (M): M = (A, R), где A – базовое множество атрибутов; R – множество заданных на A отношений.
При моделировании в целом и при построении теоретико-множественных моделей именно отношениям отводится важнейшее место, поскольку всякое отношение можно рассматривать как описание состояний объектов или взаимодействие. В частности, можно провести параллели между вербальным описанием объекта рассмотрения и его теоретико-множественной моделью. Действительно, каждое высказывание содержит две основные лингвистические категории: термы (денотаты) и функторы для обозначения отношений. В модели термы используются для обозначения объектов, а функторы – отношений между ними.
Пусть A – некоторое множество атрибутов. Соответствие частного вида R ⊂ A × A ≡ A2 между множеством A и этим же множеством A обычно называют бинарным отношением на множестве A. Если (a, b) Î R, то говорят, что элемент a находится в отношении R с элементом b, и этот факт обычно обозначают через aRb. В общем случае можно рассматривать отношения между n-элементами, то есть n-местные отношения R ⊂ An [17].
Теоретико-множественная модель пациента с печеночной недостаточностью строится на основании отнесения синдромов, симптомов и других проявлений заболевания с их характеристиками и значениями к трем множествам – критерии включения, критерии исключения и неспецифические критерии. Основные критерии, характеризующие разные виды печеночной недостаточности, описываемые в исследованиях из разных регионов мира, в целом совпадают, поэтому становится возможным построение единой теоретико-множественной модели. Неспецифические критерии могут отличаться, что положительно сказывается на чувствительности модели, так как, чем больше различных параметров для выбора, тем более точную модель пациента можно построить и тем более специфичное лечение можно подобрать. Моделью конкретного пациента является область пересечения данных множеств в зависимости от характеристик и значений признаков, составляющих подмножества.
Планируемая программная реализация
Реализация системы предполагает два этапа: первый этап – обучение модели, второй – тестиро- вание и эксплуатация.
Для обучения модели необходимы релевантные данные о клинических исследованиях, которые могут быть получены, в первую очередь, из медицинских статей. Зачастую такие данные никак не формализованы и представлены на естественном языке. Для автоматизированного выделения необходимых данных из блоков текста более всего подходят методы машинного обучения, конкретнее – метод обучения с учителем. В качестве обучающей выборки будут использованы данные из статей, размеченных экспертами.
Эксперт размечает предоставленные статьи, посвященные печеночной недостаточности, выделяет структуру. На основании данных о симптомах, вводимом препарате, а также о результатах лечения он разносит пациентов по группам. Данные могут быть представлены как в числовом, так и в текстовом виде. Получаемые данные неоднородны, поэтому для дальнейшей работы необходимо преобразовать их в векторный вид. Более подробно механизм автоматического извлечения данных описан в [1]. Далее, используя размеченную обучающую выборку, с помощью методов машинного обучения будет построен механизм фильтрации литературных источников, способный решать задачи прогнозирования, сопоставления, оценки эффекта, сравнения методик лечения.
На этапе тестирования и эксплуатации будет разработан веб-интерфейс, который позволит врачу вводить данные о пациенте и ставить клинический вопрос. Затем последует отбор релевантных относительно клинического вопроса публикаций и данные будут обрабатываться с помощью построенных моделей. Ввод запросов будет доступен либо в формате PICO, либо, для удобства пользователя, на естественном языке. Врач в качестве вывода получает ответ на поставленный вопрос и ссылки на публикации, на основании которых был дан ответ. Для визуализации полученных результатов и самостоятельного сравнения результатов пользователями будет реализован ряд шкал, калькуляторов и сравнительных таблиц.
Наиболее подходящим языком для програм- мной реализации является Python. Существует ряд библиотек для Python, обеспечивающих удобство работы с большими объемами данных, позволяющих реализовывать механизмы машинного обучения или анализа данных. Для работы с массивами данных предполагается использовать библиотеку Pandas, для реализации сложных математических функций – NumPy, для реализации алгоритмов машинного обучения – SKlearn, для графического представления данных – SciPy.
Заключение
Схемы диагностики печеночной недостаточности в разных регионах мира и подбор лечения имеют различия. Для проведения грамотного мета- анализа литературных источников в целях подбора наиболее адекватной персональной терапии необходимо предварительное построение модели заболевания, учитывающей особенности клинических проявлений печеночной недостаточности у отдельных групп пациентов, то есть модели «пациента». В этом случае подбор медикаментозной терапии будет ориентирован на специфические к особенностям конкретного больного симптомокомплексы. Основой для этого является теоретико-множественное описание, представляющее универсальную модель, поскольку она может быть применена к весьма широкому классу систем [17]. Выбор инструмента для метаанализа в создаваемом программном продукте будет определяться пользо- вателем на основе его опыта и предполагаемой терапии с учетом специфики патологических изменений.
Таким образом, создаваемый интегрированный программный продукт для подбора оптимально- го варианта медикаментозного воздействия при разных вариантах преобладания поражения отдельных систем организма при печеночной недостаточности будет опираться на теоретико-множественную модель, используемую в масштабном метаанализе мировой литературы.
Работа выполнена при поддержке РФФИ, проект № 16-29-07354.
Литература
1. Kelley G.A., Kelley K.S. Statistical models for meta-analysis: A brief tutorial. World Jour. of Methodology, 2012, vol. 2, no. 4, pp. 27–32.
2. Petitti D.B. Meta-analysis, decision analysis and cost-effectiveness analysis: methods for quantitative synthesis in medicine, 2nd ed. NY, Oxford Univ. Press, 2000, 306 p.
3. Турдалиева Б.С., Рахматуллаева Н.У., Тен В.Б., Раушанова А.М., Мусаева Б.А., Омарова Д.Б. Метаанализ как инструмент доказательной медицины // Вестн. КазНМУ. 2011. № 4. С. 99–105.
4. Higgins J.P.T., Thompson S.G. Quantifying heterogeneity in a meta-analysis. Statistics in Medicine, 2002, vol. 21, no. 11, pp. 1539–1558.
5. Мастицкий С.Э., Шитиков В.К. Статистический анализ и визуализация данных с помощью R. 2014. URL: http://r-analytics.blogspot.com (дата обращения: 27.01.2017).
6. Efron B. Empirical Bayes methods for combining likelihoods. JASA, NY, 1996, vol. 91, pp. 538–550.
7. Gelijns A.C. (ed.). Modern methods of clinical investigation. National Acad. Press, Washington, 1990, 244 p.
8. Morris C.N. Parametric empirical Bayes inference: theory and applications. Jour. of the American Statistical Assoc., 1983, vol. 78, pp. 47–55.
9. Калинин А.Л., Литвин А.А., Тризна Н.М. Использование данных доказательной медицины в клинической практике (обзор литературы) // Проблемы здоровья и экологии. 2008. № 2. С. 27–32.
10. Богомолов А.В., Кукушкин Ю.А. Математическое обеспечение метаанализа результатов независимых экспериментальных медико-биологических исследований // Информатика и системы управления. 2011. № 4. С. 65–74.
11. Анализ зависимостей. Лекция № 7. URL: http://web- local.rudn.ru/web-local/prep/rj/files.php?f=pf_3f44e44a78311893 cd1fcb4ac5464155 (дата обращения: 27.01.2017)
12. Хорошилов С.Е., Половников С.Г., Асташев В.Л., Скворцов С.В., Кудряшов С.К., Хазанов А.И. Острая (молниеносная) и острая/хроническая печеночная недостаточность: возможности коррекции альбуминовым диализом на аппарате MARS // Российский журнал Гастроэнтерологии, Гепатологии, Колопроктологии. 2007. № 2. С. 57–62.
13. Скворцов В.В., Скворцова З.С., Лешина О.А. Патогенез, клиника, диагностика и лечение печеночной комы // Поликлиника. 2012. № 2. С. 98–103.
14. Радченко В.Г., Шабров А.В., Зиновьева Е.Н. Основы клинической гепатологии. Заболевания печени и билиарной системы. СПб: БИНОМ, 2005. 864 с.
15. Kim T.Y., Kim D.J. Acute-on-chronic liver failure. Clinical and Molecular Hepatology, 2013, vol. 19, no. 4, pp. 349–359.
16. Кутепов Д.Е. Использование экстракорпоральных методов лечения печеночной недостаточности // Казанский мед. журн. 2014. Т. 95. № 1. С. 75–79.
17. Воронов М.В. Моделирование слабоструктурированных проблем. М.: Изд-во СГУ, 2010. 332 с.
18. Петровский А.Б. Упорядочивание и классификация объектов с противоречивыми признаками // Новости искусственного интеллекта. 2003. № 4. С. 34–43.
19. Рассел Б. Философия логического атомизма. Томск: Водолей, 1999. 192 с.
20. Кобринский Б.А. Образные ряды и их отображение в базе знаний // КИИ-2008: тр. 11-й национальн. конф. по искусствен. интел. с междунар. участием. Т. 1. М.: Ленанд, 2008. С. 393–400.
References
- Kelley G.A., Kelley K.S. Statistical models for meta-analysis: A brief tutorial. World Jour. of Methodology. Publ. online, 2012, vol. 2, no. 4, pp. 27–32.
- Petitti D.B. Meta-analysis, Decision Analysis and Cost-effectiveness Analysis: Methods for Quantitative Synthesis in Medicine. 2nd ed. NY, Oxford Univ. Press, 2000, 306 p.
- Turdalieva B.S., Rakhmatullaeva N.U., Ten V.B., Raushanova A.M., Musaeva B.A., Omarova D.B. A meta-analysis as a tool for evidence-based medicine. Vestnik KazNMU [Bulletin KazNMU]. 2011, no. 4, pp. 99–105 (in Russ.).
- Higgins J.P.T., Thompson S.G. Quantifying heterogeneity in a meta-analysis. Statistics in Medicine. 2002, vol. 21,
no. 11, pp. 1539–1558.
- Mastitsky S.E., Shitikov V.K. Statistichesky analiz i vizualizatsiya dannykh s pomoshchyu R [Statistical Analysis and Data Visualization Using R]. 2014. Available at: http://r-analytics.blogspot.com (accessed January 27, 2017).
- Efron B. Empirical Bayes methods for combining likelihoods. Jour. Amer. Statist. Assoc. NY, 1996, vol. 91,
pp. 538–550.
- Modern methods of clinical investigation. A.C. Gelijns (Ed.). Committee on Technological Innovation in Medicine, Institute of Medicine. National Academy Press, Washington, 1990, 244 p.
- Morris C.N. Parametric empirical Bayes inference: theory and applications. Jour. of the Amer. Statist. Assoc. 1983, vol. 78, pp. 47–55.
- Kalinin A.L., Litvin A.A., Trizna N.M. Use of data of evidence based medicine in clinical practice (literature review). Problemy zdorovya i ekologii [Health and Ecology Problems]. 2008, no. 2, pp. 27–32 (in Russ.).
- Bogomolov A.V., Kukushkin Yu.А. Mathematical support for meta-analysis of independent experimental biomedical research. Informatika i sistemy upravleniya [Information Science and Control Systems]. 2011, no. 4, pp. 65–74 (in Russ.).
- Analiz zavisimostey. Lektsiya № 7 [Dependency analysis. Lecture No. 7]. Available at: http://web-local.rudn.ru/web-local/prep/rj/files.php?f=pf_3f44e44a78311893cd1fcb4ac5464155 (accessed January 27, 2017).
- Khoroshilov S.E., Polovnikov S.G., Astashev V.L., Skvortsov S.V., Kudryashov S.K., Khazanov A.I. Acute (fulminant) and acute/chronic hepatic failure: potential for correction by albumin dialysis with MARS device. Rossiysky zhurnal Gastroenterologii, Gepatologii, Koloproktologii [The Russian Jour. of Gastroenterology, Hepatology, Coloproctology]. 2007, no. 2, pp. 57–62 (in Russ.).
- Skvortsov V.V., Skvortsova Z.S., Leshina O.A. Pathogenesis, clinic, diagnostics and treatment of hepatic coma. Poliklinika [Polyclinic]. 2012, no. 2, pp. 98–103 (in Russ.).
- Radchenko V.G., Shabrov A.V., Zinovyeva E.N. Osnovy klinicheskoy gepatologii. Zabolevaniya pecheni i biliarnoy sistemy [Fundamentals of Clinical Hepatology. Diseases of the Liver and Biliary System]. St. Petersburg, BINOM Publ., 2005, 864 p.
- Kim T.Y., Kim D.J. Acute-on-chronic liver failure. Clinical and Molecular Hepatology. 2013, vol. 19, no. 4,
pp. 349–359.
- Kutepov D.E. Extracorporal methods for liver failure treatment. Kazansky meditsinsky zhurnal [Kazan Medical Jour.]. 2014, vol. 95, no. 1, pp. 75–79 (in Russ.).
- Voronov M.V. Modelirovanie slabostrukturirovannykh problem [Modeling Semi-structured Problems]. Moscow, SGU Publ., 2010, 332 p.
- Petrovsky A.B. Odering and classifying objects with contradictory attributes. Novosti iskusstvennogo intellekta [AI News]. 2003, no. 4, pp. 34–43 (in Russ.).
- Russell B. Filosofiya logicheskogo atomizma [Logical Atomism Philosophy]. Tomsk, Vodoley Publ., 1999, 192 p.
- Kobrinsky B.A. Image series and their representation in the knowledge base. Sb. tr. 11oy nats. konf. po iskusstvennomu intellektu s mezhdunar. uchastiem KII-2008 [Proc. 11th National Conf. on Artificial Intelligence with Int. Participation CAI-2008]. Мoscow, Lenand Publ., 2008, vol. 1, pp. 393–400 (in Russ.).
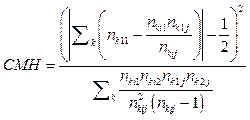 .
.
